Про зрение: в России вырастили клетки сетчатки, встраивающиеся в глаза
Ученые МФТИ в сотрудничестве с исследователями Гарварда вырастили клетки сетчатки, которые способны врастать в глаза. Это первая в мире успешная попытка трансплантации ганглионарных клеток (нейроны сетчатки, которые разрушаются при глаукоме), полученных из стволовых клеток в лабораторных условиях. Далее выращенные клетки нужно будет трансплантировать в сетчатку. Ученые проверили технологию на мышах и удостоверились в успешном встраивании клеток и их выживании на протяжении года. В дальнейшем исследователи планируют создать специализированные банки клеток, которые позволят индивидуально подбирать терапию для каждого пациента.
Первую в мире успешную попытку выращивания и трансплантации ганглионарных клеток сетчатки из стволовых произвели ученые лаборатории геномной инженерии МФТИ в сотрудничестве с исследователями Гарвардской медицинской школы. Ганглионарные клетки ответственны за передачу зрительной информации, и именно они повреждаются при глаукоме. Ученым удалось не только вырастить нейроны (ганглионары считаются специализированными нейронами), но и трансплантировать их в глаза мышей, добившись правильного врастания искусственной ткани сетчатки. Как известно, без лечения развитие глаукомы может привести к необратимому повреждению части зрительного нерва и, как следствие, потери части визуального поля. Прогрессируя в течение долгого времени, эта болезнь может привести и к полной слепоте.
Клетки сетчатки были выращены в специальных органоидах, ткань формировалась в пробирке, рассказал «Известиям» младший научный сотрудник лаборатории геномной инженерии МФТИ Евгений Кегелес. Потом эти клетки пересадили мышам, которые были распределены в несколько групп.
— Были мыши с моделью глаукомы, мыши с повышенным внутриглазным давлением и те, у которых были удалены собственные ганглионары, — отметил Евгений Кегелес. — Были также новорожденные мыши: мы проверяли гипотезу более успешной приживаемости молодых ганглионарных клеток в формирующейся сетчатке. В результате оказалось, что клетки встроились и прорастили аксоны, которые позволят связать глаз с мозгом. Улучшенная выживаемость клеток у новорожденных мышей дает нам перспективное направление для поиска наилучшего микроокружения.
По словам Евгения Кегелеса, эти клетки успешно просуществовали внутри сетчатки 12 месяцев, что является серьезным сроком для такого исследования. Ученым удалось убедиться, что они получают зрительные сигналы, однако то, что клетки передают сигналы в мозг, со стопроцентной уверенностью утверждать пока нельзя.
— Мы точно знаем, что выращенные клетки встраиваются куда надо, протягивают аксоны в мозг, но их функциональность оценить пока невозможно, — объяснил Евгений Кегелес. — Это связано с тем, что до сих пор нам не удалось вырастить большое количество клеток. Это вопрос ближайших лет.
По его словам, исследователям нужен год, чтобы они смогли оценить функциональность клеток на мышиных моделях. В течение этого времени можно будет получить доказательство, что клетки не просто правильно встроены в структуру глаза, а они именно «видят».
Клеточный банк
Сейчас мышиные клетки сетчатки удается вырастить примерно за 21 день. В случае человека это будет от 50 до 100 дней, говорят ученые МФТИ.
Однако, скорее всего, человеку с глаукомой, готовящемуся к трансплантации, не нужно будет выращивать ткань сетчатки из собственных стволовых клеток. Так как глаз является иммунопривилегированным органом, где отторжения редки, возможно создать банк клеток для таких пациентов. Там будут размещены или выращенные клетки сетчатки от универсального донора, или из индуцированных плюрипотентных стволовых клеток. Это значит, что можно будет заранее вырастить клетки, заморозить их и, когда пациент с глаукомой обратится за помощью, подобрать для него наилучший клеточный вариант для трансплантации.
Впоследствии эту технологию можно будет применять и для лечения других заболеваний глаз, например дистрофии сетчатки. Однако выращивать придется другие клетки.
— Нобелевскую премию за индуцированные плюрипотентные стволовые клетки дали почти 10 лет назад, в 2012 году, — отметил руководитель лаборатории геномной инженерии Павел Волчков. — Так называемый хайп, когда буквально все научные коллективы считали своим долгом заниматься этой тематикой, давно угас. Сейчас настало время не просто слов, а реальных технологий на основе iPS (искусственные плюрипотентные стволовые клетки человека. — «Известия»). И именно к таким технологиям относится исследование по трансплантации ганглионаров сетчатки. Это возможность показать, что стволовые клетки реально можно применить на практике, с их помощью можно что-то исправить. Хотя эта работа еще не доведена до клиники, но она уже в нескольких шагах от реальной пересадки с целью лечения глаукомы.
Учитывая большой опыт экспериментальных работ мировых ученых и активное изучение вопроса заместительной клеточной терапии в офтальмологии, в дальнейшем метод может привести к прорыву в диагностике и лечении глаукомы, считает заведующая отделением офтальмологии ФГБУ НМИЦО ФМБА России, действительный член Европейского общества катарактальных и рефракционных хирургов (ESCRS), член Российского общества офтальмологов Ника Тахчиди.
— В ряде зарубежных работ показано, что введенные клетки встраиваются в сетчатку и частично дифференцируются в клетки сетчатки. В настоящее время описаны и обсуждаются два основных механизма действия клеток in vivo и in vitro. Замещающая терапия — когда клетки, образующиеся в результате дифференцировки введенных стволовых клеток, «включаются» в восстанавливаемую ткань. «Эффект стороннего наблюдателя» — когда вводимые стволовые клетки оказывают противовоспалительное, трофическое или иммуномодулирующее действие на восстанавливаемую ткань. Однако, несмотря на прорыв в изучении морфофунциональных свойств стволовых клеток, обеспечить гарантированное послойное замещение культивированными клетками поврежденных участков сетчатки при использовании практикуемых методов введения на сегодняшний день невозможно, что и подтверждается рядом экспериментальных работ, — сказала Ника Тахчиди.
Впрочем, многие ученые в мире сейчас работают в этом направлении, пытаясь создать клеточную терапию лечения атрофии зрительного нерва, дистрофии сетчатки и глаукомы, отметила заведующая отделением офтальмологии клинико-диагностического центра «Медси», врач-офтальмолог Ирина Евсегнеева.
— Но никаких данных на сегодняшний день о том, что пересаженные клетки передают изображение, нет. Любая идея, как это сделать, заслуживает внимания, — сказала она.
По оценке ученых МФТИ, на доведение технологии до применения в лечебной практике уйдет примерно 10 лет.
EURETINA 2020: обнародованы результаты исследований в области сетчатки глаза
На виртуальной конференции Европейского общества специалистов по сетчатке глаза (EURETINA 2020) были представлены результаты недавних исследований в данной области. Среди рассмотренных тем присутствовали: влияние субпорогового лазера на темпы прогрессирования возрастной географической атрофии; эффективность использования импланта с ранибизумабом для снижения нагрузки лечения у пациентов с влажной формой ВМД; применение дексаметазона при диабетической макулопатии, не поддающейся анти-VEGF терапии.
Субпороговый лазер способен замедлить прогрессирование возрастной географической атрофии
По данным экспертов из группы Retina Vitreous Medical Group в Вентуре, штат Калифорния, панретинальное субпороговое микроимпульсное лазерное воздействие (СМИЛВ) с использованием диодного лазера может ускорить восстановление клеток сетчатки глаза и замедлить прогрессирование возрастной географической атрофии. Результаты исследования представлены в Clinical Ophthalmology.
В ходе исследования проанализировали прогрессирование поражений сетчатки глаза у пациентов с возрастной географической атрофией до и после СМИЛВ с использованием диодного лазера. Всего оценили состояние 67 глаз у 49 пациентов.
67 глаз участников подверглись сплошному воздействию лазера Oculight SLx компании Iridex с длиной волны 810 нм, диаметром пятна 200 мкм, 5%-ым рабочим циклом, мощностью 1,43 Вт и продолжительностью импульса, равной 0,15 сек. Курс терапии повторялся каждые 3 — 4 месяца со средним интервалом в 112 дней. Средний период наблюдения за состоянием глаз участников составил 910 дней (2,5 года) до и 805 дней (2,2 года) после лечения с применением СМИЛВ.
В результате, установили, что скорость линейного радиального роста поражений сетчатки глаз участников снизилась на 47% в год благодаря лечению со СМИЛВ с использованием диодного лазера. При этом, исследователи не зарегистрировали побочных реакций, вызванных терапией.
Исследована эффективность импланта с ранибизумабом для снижения нагрузки лечения при влажной форме ВМД
Имплант Port Delivery System (PDS) с ранибизумабом (ranibizumab) может снизить нагрузку лечения и даже улучшить долгосрочную остроту зрения у пациентов с влажной формой возрастной макулярной дегенерации (ВМД). К такому выводу пришли эксперты из глазной клиники Wills Eye Hospital в Филадельфии. Результаты исследования Archway фазы III опубликованы на портале Medscape Medical News.
Исследователи сравнили эффективность импланта PDS с ранибизумабом против ежемесячных интравитреальных инъекций ранибизумаба для пациентов с влажной формой ВМД. 248 участникам исследования должны были провести хирургическую установку импланта, а другим 167 предложили инъекции ранибизумаба (0,5 мг каждые 4 недели).
Установили, что в течение 40 недель пациенты с имплантом нуждались в гораздо меньшем количестве терапевтических процедур, чем те, кому проводили инъекции ранибизумаба (в среднем 2 против 10,7). При этом, показатель поддержания зрения, представленный в форме разницы между исходной и максимально корригированной остротой зрения, в среднем за 36 — 40 недель был одинаковым среди участников обеих групп лечения.
Однако испытуемые, подвергшиеся хирургическому вмешательству по установлению импланта PDS с ранибизумабом, были подвержены большему риску развития побочных эффектов. Так, например, частота кровоизлияний в стекловидное тело была выше среди пациентов группы импланта, по сравнению с группой инъекций (4% против 2,4%). Частота возникновения катаракты также была выше у участников, которым установили имплант (4% против 3,6%).
Дексаметазон может помочь при диабетической макулопатии, не поддающейся анти-VEGF терапии
По данным экспертов из Автономного Университета Мадрида (Autonomous University of Madrid) и образовательного и исследовательского медицинского учреждения Фатих Султан Мехмет (Fatih Sultan Mehmet Education and Re Hospital) в Стамбуле, дескаметазон может помочь пациентам с диабетической макулопатией (ДМ), на которых лечение ингибиторами фактора роста эндотелия сосудов (анти‐VEGF) не оказывает необходимого эффекта.
Анализ сведений из базы данных Diabetic Retinopathy Clinical Re Network в 2018 г. показал, что спустя два года после лечения ранибизумабом в 40% глаз участников сохранялся макулярный отек, что говорило о необходимости поиска альтернативы. Вместе с тем, у экспертов отсутствовали однозначные сведения по поводу того, как долго следует ждать ответа анти-VEGF терапии, прежде чем можно будет переходить на дексаметазон.
Для изучения этой проблемы исследователи рассмотрели данные пациентов, у которых был зарегистрирован неадекватный ответ после трех инъекций анти-VEGF препаратов. Участники испытания соответствовали по крайней мере один из следующих критериев:
- неулучшающаяся максимально корригированная острота зрения (МКОЗ);
- уменьшение центральной толщины сетчатки менее чем на 20%;
- рецидив макулярного отека несмотря на ежемесячные интравитреальные инъекции;
- ухудшение макулярного отека при стабильной МКОЗ;
- обострение макулярного отека наряду с ухудшением МКОЗ.
Эксперты обнаружили, что состояние 32 глаз, которые получили только ударную дозу из 3 инъекций афлиберцепта (aflibercept) до перехода на интравитреальный имплантат дексаметазона, улучшилось на 169,1%. В то же время состояние других 76 глаз, которые перешли на дексаметазон после более чем 3 инъекций, улучшилось лишь на 63,8%. Разница в данных показателях оказалось существенной, что позволило исследователям сделать вывод о том, что быстрый и полный переход на дексаметазон при условии неэффективности анти-VEGF терапии может помочь пациентам с ДМ.
Глаза киборга: 5 технологий, которые вернут человеку зрение
Кто бы мог представить еще 10 лет назад, что человек будет различать цвета или заново увидит контуры предметов и фигур после слепоты. Но современные технологии позволили в буквальном смысле взглянуть на мир по-новому и дали огромный толчок творческому мышлению в медицине и офтальмологии в частности. Директор по маркетингу компании Essilor Елена Балаян рассказывает о киборгизации — ключевом тренде восстановления зрения при помощи различных имплантов.
Бионические глаза, искусственная сетчатка, вшиваемые чипы и специальные носимые устройства борются с потерей зрения — всё это уже реальность, а не сценарий фантастического фильма. А развитие вычислительной техники, 3D-печати делает эти устройства, помогающие человеку справиться с заболеваниями глаз, дешевле и удобнее. Правда, и сегодня на создание одной сетчатки глаза уходит до 50 недель и свыше $100 тыс.
Поиск цвета: антенна для визуального звука
Нил Харбиссон, музыкант и художник из Каталонии, родился с редким заболеванием — ахроматопсией, и мог видеть только в черно-белых тонах. Такой болезнью он страдал до 21 года, пока не встретил Адама Монтадона, который рассказал о своем новом проекте Eyeborg. Эта система переводит цвета в определенные звуки, чтобы человек по-новому воспринимал мир.
Монохромазия — отсутствие цветовосприятия. Является нормальным состоянием у некоторых видов животных. В случае человека монохромазия, или полная цветовая слепота, является заболеванием. Человек, страдающий ею, различает цвета только по их яркости. При этом выделяют две формы монохромазии:
- ахроматопсия, или палочковая монохромазия, при которой отсутствуют колбочки и световые волны любой длины воспринимаются как ощущение серого цвета;
- колбочковая монохромазия, при которой разные цвета воспринимаются как какой-то один цветовой тон.

Нил Харбиссон с антенной, торчащей из его затылка
В рамках программы Eyeborg Нил сам вызвался добровольцем для опыта имплантации специального чипа с антенной в затылочную кость. Харбиссон начал воспринимать окружающую цветовую палитру и идентифицировать каждый оттенок с определённой музыкальной тональностью. Теперь он даже различает инфракрасные и ультрафиолетовые оттенки, недоступные человеческому диапазону зрения.
Изначально Нил носил на себе огромную и тяжелую конструкцию весом больше 5 кг, которая еще и долго заряжалась. Теперь из затылка Нила торчит вполне компактная антенна, а обычных батареек хватает на месяц использования. Более того, он отстоял право у британских властей сфотографироваться на паспорт с выступающей из головы антенной. По словам музыканта, это устройство, позволяющее прочувствовать свет, — неотъемлемая часть его тела. Лечить зрение можно даже не прикасаясь к глазам, главное — суметь найти корректные решения для воздействия на мозг.
Бионические глаза: обращение слепоты вспять
Макулодистрофия, пигментный ретинит и наследственные заболевания глаз раньше вызывали постепенную потерю зрения или слепоту примерно у 1,5 млн человек по всему миру, теперь же успешно многие из них будут вылечены с помощью высокотехнологичных инноваций.
Макулодистрофия — общее название для группы заболеваний, при которых поражается сетчатка глаза и нарушается центральное зрение. В основе макулодистрофии лежит патология сосудов и ишемия центральной зоны сетчатки, отвечающей за центральное зрение. Возрастная макулодистрофия — одна из самых частых причин слепоты у людей старше 55 лет.
Пигментный ретинит — наследственное дегенеративное заболевание глаз, которое вызывает сильное ухудшение зрения и часто слепоту.
Argus II, разработанный компанией Second Sight, не задействует механизм работы глаз, а вместо этого мобилизует часть мозга, отвечающую за обработку визуальной информации, — зрительную кору, тем самым восстанавливая минимальное зрение. Устройство состоит из двух элементов: имплантата сетчатки и внешней системы, вмонтированной в очки камеры в комбинации с небольшим процессором. Камера записывает изображения в реальном времени, далее встроенный видеопроцессор обрабатывает и отправляет их по беспроводной сети имплантату. Подача электрических импульсов помогает мозгу воспринимать световую картину. Компания надеется, что это нововведение поможет 6 млн людей, которые имеют риск серьезных нарушений зрения из-за рака, диабетической ретинопатии, глаукомы или различного рода травм.
В 2015 году хирурги из Манчестера (Великобритания) установили первый бионический глазной имплант пациенту с диагнозом «макулодистрофия». Так, 80-летний Рэй Флинн полностью потерял зрение, а с помощью импланта сетчатки снова смог различать формы на экране компьютера. Имплант пока не может обеспечить высокодетальное зрение, но помогает пациентам распознавать четкие узоры и объемные фигуры.
Цифровые контактные линзы и 3D-биопринтинг
3D-биопринтинг — технология создания объемных моделей на клеточной основе с использованием 3D-печати, при которой сохраняются функции и жизнеспособность клеток. У 3D-печати действительно большие перспективы использования в офтальмологии. Она позволяет экономично проектировать и изготавливать глаукомные клапаны, контактные линзы и интраокулярные импланты. Биопечать открывает новые возможности для трансплантации: печать жизнеспособных тканей приведет в итоге к созданию функционирующей роговицы, а затем и сетчатки. Также важно, что в формате 3D можно печатать анатомические модели и использовать в качестве наглядных пособий для медицинских работников, проводить более точную диагностику, лечение и обучение как пациентов, так и их семей.
Пока инновационные решения позволяют человеку различать лишь контуры и формы предметов, но ученые прогнозируют, что в ближайшем будущем качество изображения улучшится и станет детальнее. Будут совершенствоваться и носимые компоненты системы, превращающей людей в киборгов, — сейчас она состоит из множества составляющих (камеры, очки, кабели), что не совсем удобно. Скоро мы увидим, как чипы без внешних вспомогательных элементов максимально комфортно входят в жизнь людей.
Искусственная сетчатка
Исследователи из Тель-Авивского университета, Еврейского университета в Иерусалиме и Ньюкаслского университета создали рабочий прототип искусственной сетчатки глаза, которая поможет в лечении ряда заболеваний глаз, в том числе возрастной макулярной дегенерации.
Искусственная сетчатка для глаз изготовлена из полупроводниковых наностержней и углеродных нанотрубок, обеспечивающих гибкость, свойственную естественной форме глаза. В ходе ранних испытаний было выявлено, что искусственная сетчатка вызывает реакцию на свет у животных, которые не были чувствительны к свету.
В лаборатории геномной инженерии МФТИ вырастили десятки тысяч искусственных сетчаток, чтобы на основе машинного обучения создать систему, способную самостоятельно отбирать и выращивать ткани для трансплантации. В основе системы — ИИ распознавания изображений. Сейчас процесс создания искусственной сетчатки стоит около $100 тыс. и занимает от 30 до 50 недель. Разработка российских ученых — это маленький шаг в будущее, но время и стоимость этой технологии сократятся вдвое.
Микроиголки как способ доставки лекарства
Даже если глазные капли не смылись сразу, их всасываемость не превышает 5%. Еще 10 лет назад в топ трендов для лечения глаукомы, катаракты и сухости глаз входили контактные линзы с витамином Е. Природный элемент блокирует ультрафиолетовый свет, не снижая прозрачность линзы, и полезен для профилактики заболеваний. Подразумевалось, что линзы с этим нутрицевтиком продлят доставку препарата к глазу, уменьшат системное всасывание и, следовательно, снимут с повестки проблему побочных эффектов антиглаукомных препаратов, а носить такие линзы можно будет до 30 дней. Ученые уже тогда понимали, что лечение станет эффективнее, если облегчить и процесс введения препарата — только половина пациентов соблюдает протокол ежедневного введения лекарств при глаукоме.
Спустя 10 лет при многих глазных заболеваниях лучшим средством остается применение лекарств непосредственно в глаза. Группа исследователей из Сингапура создала гибкую полимерную накладку с закрепленным на ней набором микроигл с функцией резервуаров. Проникая внутрь глаза благодаря двухслойной структуре, микроиглы вводят несколько лекарственных веществ одновременно. Серия in vitro и in vivo экспериментов подтвердила эффективность и безопасность: через пять дней площадь неоваскуляризации снизилась на 90% с двухслойной структурой микроигл и на 44% с быстро растворяющимися обычными микроиглами. Видимого результата не дало только применение глазных капель с тем же лекарственным веществом.
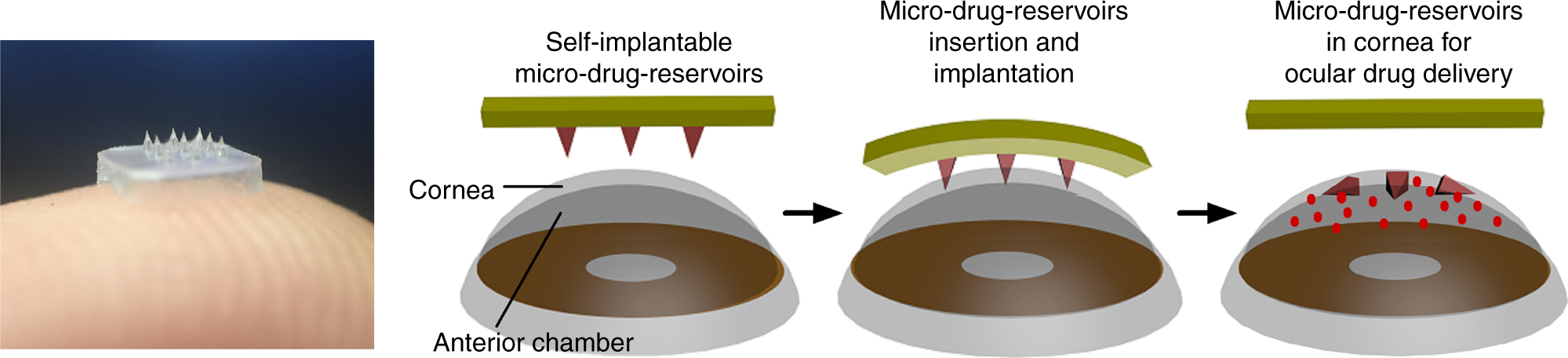
Полимерная накладка на глаз с микроиглами
Исследователи из Университета Georgia Tech & Emory работают над микроиголками для безопасного и эффективного лечения. Новые технологии уменьшают размеры игл и варьируют площадь нанесения, тем самым упрощая процесс введения лекарства. Уже сейчас ясно, что накладки с микроиглами окончательно «победят» глазные капли — уже от одного применения пациент получит более длительный эффект.
Киборгизация неизбежна, и ее наступление предсказал еще британский физик Джон Десмонд Бернал в книге 1929 года «Мир, плоть и дьявол». Киборгизация пугает ровно до тех пор, пока жизнь не предоставляет повода с ней столкнуться лично: для людей с ограниченными возможностями это эффективный инструмент вернуть качество жизни и некоторые функции. Как в случае с Нилом Харбиссоном. Эмоции людей, обретших зрение вновь, вдохновляют ученых на покорение новых вершин технологий.
- Харенко Е. А., Ларионова Н. И., Демина Н. Б. Мукоадгезивные лекарственные формы. Химико-фармацевтический журнал. 2009; 43(4): 21–29. DOI: 10.30906/0023-1134-2009-43-4-21-29.
- Sprengel, «Pragmatische Geschichte der Heilkunde».
- Patil H., Tiwari R. V., Repka M. A. Recent advancements in mucoadhesive floating drug delivery systems: A mini-review. Journal of Drug Delivery Science and Technology. 2016; 31: 65–71.DOI: 10.1016/j.jddst.2015.12.002.
- https://iz.ru/1137169/anna-urmantceva-mariia-nediuk/pro-zrenie-v-rossii-vyrastili-kletki-setchatki-vstraivaiushchiesia-v-glaza.
- https://medvestnik.ru/content/medarticles/EURETINA-2020-obnarodovany-rezultaty-issledovanii-v-oblasti-setchatki-glaza.html.
- https://hightech.fm/2020/04/07/5-tech-eyes.
- Frédault, «Histoire de la médecine» (П., 1970).
- Киржанова Е. А., Хуторянский В. В., Балабушевич Н. Г., Харенко А. В., Демина Н. Б. Методы анализа мукоадгезии: от фундаментальных исследований к практическому применению в разработке лекарственных форм. Разработка и регистрация лекарственных средств. 2014; 3(8): 66–80. DOI: 10.33380/2305-2066-2019-8-4-27-31.
- Haeser, «Handbuch der Gesch. d. Medicin».
- Скориченко, «Доисторическая M.» (СПб., 1996); его же, «Гигиена в доисторические времена» (СПб., 1996).