Про зрение: в России вырастили клетки сетчатки, встраивающиеся в глаза
Ученые МФТИ в сотрудничестве с исследователями Гарварда вырастили клетки сетчатки, которые способны врастать в глаза. Это первая в мире успешная попытка трансплантации ганглионарных клеток (нейроны сетчатки, которые разрушаются при глаукоме), полученных из стволовых клеток в лабораторных условиях. Далее выращенные клетки нужно будет трансплантировать в сетчатку. Ученые проверили технологию на мышах и удостоверились в успешном встраивании клеток и их выживании на протяжении года. В дальнейшем исследователи планируют создать специализированные банки клеток, которые позволят индивидуально подбирать терапию для каждого пациента.
Первую в мире успешную попытку выращивания и трансплантации ганглионарных клеток сетчатки из стволовых произвели ученые лаборатории геномной инженерии МФТИ в сотрудничестве с исследователями Гарвардской медицинской школы. Ганглионарные клетки ответственны за передачу зрительной информации, и именно они повреждаются при глаукоме. Ученым удалось не только вырастить нейроны (ганглионары считаются специализированными нейронами), но и трансплантировать их в глаза мышей, добившись правильного врастания искусственной ткани сетчатки. Как известно, без лечения развитие глаукомы может привести к необратимому повреждению части зрительного нерва и, как следствие, потери части визуального поля. Прогрессируя в течение долгого времени, эта болезнь может привести и к полной слепоте.
Клетки сетчатки были выращены в специальных органоидах, ткань формировалась в пробирке, рассказал «Известиям» младший научный сотрудник лаборатории геномной инженерии МФТИ Евгений Кегелес. Потом эти клетки пересадили мышам, которые были распределены в несколько групп.
— Были мыши с моделью глаукомы, мыши с повышенным внутриглазным давлением и те, у которых были удалены собственные ганглионары, — отметил Евгений Кегелес. — Были также новорожденные мыши: мы проверяли гипотезу более успешной приживаемости молодых ганглионарных клеток в формирующейся сетчатке. В результате оказалось, что клетки встроились и прорастили аксоны, которые позволят связать глаз с мозгом. Улучшенная выживаемость клеток у новорожденных мышей дает нам перспективное направление для поиска наилучшего микроокружения.
По словам Евгения Кегелеса, эти клетки успешно просуществовали внутри сетчатки 12 месяцев, что является серьезным сроком для такого исследования. Ученым удалось убедиться, что они получают зрительные сигналы, однако то, что клетки передают сигналы в мозг, со стопроцентной уверенностью утверждать пока нельзя.
— Мы точно знаем, что выращенные клетки встраиваются куда надо, протягивают аксоны в мозг, но их функциональность оценить пока невозможно, — объяснил Евгений Кегелес. — Это связано с тем, что до сих пор нам не удалось вырастить большое количество клеток. Это вопрос ближайших лет.
По его словам, исследователям нужен год, чтобы они смогли оценить функциональность клеток на мышиных моделях. В течение этого времени можно будет получить доказательство, что клетки не просто правильно встроены в структуру глаза, а они именно «видят».
Клеточный банк
Сейчас мышиные клетки сетчатки удается вырастить примерно за 21 день. В случае человека это будет от 50 до 100 дней, говорят ученые МФТИ.
Однако, скорее всего, человеку с глаукомой, готовящемуся к трансплантации, не нужно будет выращивать ткань сетчатки из собственных стволовых клеток. Так как глаз является иммунопривилегированным органом, где отторжения редки, возможно создать банк клеток для таких пациентов. Там будут размещены или выращенные клетки сетчатки от универсального донора, или из индуцированных плюрипотентных стволовых клеток. Это значит, что можно будет заранее вырастить клетки, заморозить их и, когда пациент с глаукомой обратится за помощью, подобрать для него наилучший клеточный вариант для трансплантации.
Впоследствии эту технологию можно будет применять и для лечения других заболеваний глаз, например дистрофии сетчатки. Однако выращивать придется другие клетки.
— Нобелевскую премию за индуцированные плюрипотентные стволовые клетки дали почти 10 лет назад, в 2012 году, — отметил руководитель лаборатории геномной инженерии Павел Волчков. — Так называемый хайп, когда буквально все научные коллективы считали своим долгом заниматься этой тематикой, давно угас. Сейчас настало время не просто слов, а реальных технологий на основе iPS (искусственные плюрипотентные стволовые клетки человека. — «Известия»). И именно к таким технологиям относится исследование по трансплантации ганглионаров сетчатки. Это возможность показать, что стволовые клетки реально можно применить на практике, с их помощью можно что-то исправить. Хотя эта работа еще не доведена до клиники, но она уже в нескольких шагах от реальной пересадки с целью лечения глаукомы.
Учитывая большой опыт экспериментальных работ мировых ученых и активное изучение вопроса заместительной клеточной терапии в офтальмологии, в дальнейшем метод может привести к прорыву в диагностике и лечении глаукомы, считает заведующая отделением офтальмологии ФГБУ НМИЦО ФМБА России, действительный член Европейского общества катарактальных и рефракционных хирургов (ESCRS), член Российского общества офтальмологов Ника Тахчиди.
— В ряде зарубежных работ показано, что введенные клетки встраиваются в сетчатку и частично дифференцируются в клетки сетчатки. В настоящее время описаны и обсуждаются два основных механизма действия клеток in vivo и in vitro. Замещающая терапия — когда клетки, образующиеся в результате дифференцировки введенных стволовых клеток, «включаются» в восстанавливаемую ткань. «Эффект стороннего наблюдателя» — когда вводимые стволовые клетки оказывают противовоспалительное, трофическое или иммуномодулирующее действие на восстанавливаемую ткань. Однако, несмотря на прорыв в изучении морфофунциональных свойств стволовых клеток, обеспечить гарантированное послойное замещение культивированными клетками поврежденных участков сетчатки при использовании практикуемых методов введения на сегодняшний день невозможно, что и подтверждается рядом экспериментальных работ, — сказала Ника Тахчиди.
Впрочем, многие ученые в мире сейчас работают в этом направлении, пытаясь создать клеточную терапию лечения атрофии зрительного нерва, дистрофии сетчатки и глаукомы, отметила заведующая отделением офтальмологии клинико-диагностического центра «Медси», врач-офтальмолог Ирина Евсегнеева.
— Но никаких данных на сегодняшний день о том, что пересаженные клетки передают изображение, нет. Любая идея, как это сделать, заслуживает внимания, — сказала она.
По оценке ученых МФТИ, на доведение технологии до применения в лечебной практике уйдет примерно 10 лет.
Пигментная ретинопатия: причины и способы лечения
Заболевания сетчатой оболочки глаз имеют весьма негативные последствия. Они приводят к заметному ухудшению зрения или полной его утрате. Одна из таких патологий — ретинопатия, разрушающая сосуды сетчатки. Существует несколько видов этой болезни. Узнаем, что такое пигментная ретинопатия и существуют ли способы ее лечения.
Ретинопатия — что это за болезнь?
Сетчатка наших глаз имеет разветвленную сеть сосудов.
Она содержит фоторецепторные клетки — палочки и колбочки, отвечающие за цветное и дневное зрение, его четкость, а макула (желтое пятно) сетчатки отвечает за центральное зрение. Вот почему любые патологии, поражающие эту структуру, вызывают снижение зрительных функций.
Ретинопатия характеризуется повреждением сосудов сетчатки глаза. При этом нарушается ее нормальное кровоснабжение, в результате атрофируется зрительный нерв и наступает слепота. Ретинопатия часто проявляется как осложнение гипертонии, сахарного диабета, атеросклероза, различных инфекционных заболеваний, ожирения, токсикоза и других патологий. Кроме того, патология может развиться в результате травм глазного яблока или черепно-мозговых.
Нарушение кровоснабжения становится причиной кислородного голодания сетчатки. Это, в свою очередь, приводит к появлению новых сосудов, стенки которых очень хрупкие и ломкие. Кровь просачивается сквозь них и попадает на сетчатку или стекловидное тело. Такой процесс неизменно приводит к снижению качества зрения. Могут появиться осложнения в виде глаукомы, катаракты и другие.
Пигментный ретинит — что это такое?
Данным термином называют также пигментный вид ретинопатии, или пигментную абиотрофию сетчатки. Это заболевание наследственное и считается неизлечимым, так как пока не найдено способов эффективной терапии дефектных генов. Однако, даже если ребенок родился с геном пигментного ретинита, то он не всегда будет подвержен ему. К этому могут привести особые условия: заболевания, нарушение кровообращения сосудистой оболочке и прочие провоцирующие факторы.
При развитии пигментного ретинита происходит прогрессивная потеря палочек — фоторецепторов, расположенных в сетчатке. Они начинают постепенно атрофироваться. Из-за гибели палочек, отвечающих за ночное и периферийное зрение, наступает ухудшение видимости в темноте — один из первых признаков пигментной ретинопатии. Эта патология проявляется она обычно в возрасте от 25 до 40 лет.
Данное заболевание передается с Х-хромосомой от матери к сыну, или ребенок может унаследовать дефектный ген сразу от матери и отца. Наиболее вероятным является аутосомно-доминантный вариант (когда ген наследуется от матери к сыну), поэтому пигментным ретинитом чаще болеют мужчины. В целом же заболевание диагностировано примерно у 1,5 миллионов людей на планете.
Симптомы пигментного ретинита
На начальных стадиях болезнь вообще никак себя не проявляет. Вот какие признаки могут указывать на ее наличие.
- Ослепление от яркого света.
- Ухудшение ночного зрения.
- Долгая адаптация к низкому освещению при переходе с яркого.
- Появление перед глазами пятен, черных точек, вспышек.
- Сужение поля зрения.
- Нарушение цветовосприятия.
- Двоение в глазах.
Некоторые проявления пигментного ретинита могут быть заметны только под микроскопом: атрофия зрительного нерва, поражение сосудов, кровоизлияния. По мере развития недуга у пациента происходит сужение поля зрения из-за деструкции периферических участков сетчатки. В тяжелых случаях наблюдается «туннельное» зрение. Это состояние, когда человек способен воспринимать лишь изображение, попадающее на центральную часть сетчатки — периферическое видение полностью пропадает. Возникают трудности с ориентированием в окружающем пространстве. В такой ситуации наступает инвалидность. Изменения сетчатой оболочки также затрагивают и сосуды глаза, что может привести к помутнению стекловидного тела и хрусталика, а также истончению склеры. В комплексе эти дегенеративные процессы приводят к полной потере зрения. Однако болезнь может протекать с различной скоростью. Порой пигментная ретинопатия прогрессирует довольно медленно и проявляется только в виде незначительного сужения поля зрения.
Как проводится диагностика
Для того, чтобы исключить наличие других заболеваний, требуется проведение комплекса исследований, который подтвердит или опровергнет диагноз. Дело в том, что остальные виды ретинопатии поддаются медикаментозному или хирургическому лечению, тогда как пигментный ретинит, увы, пока неизлечим. Полный офтальмологический осмотр включает в себя несколько процедур.
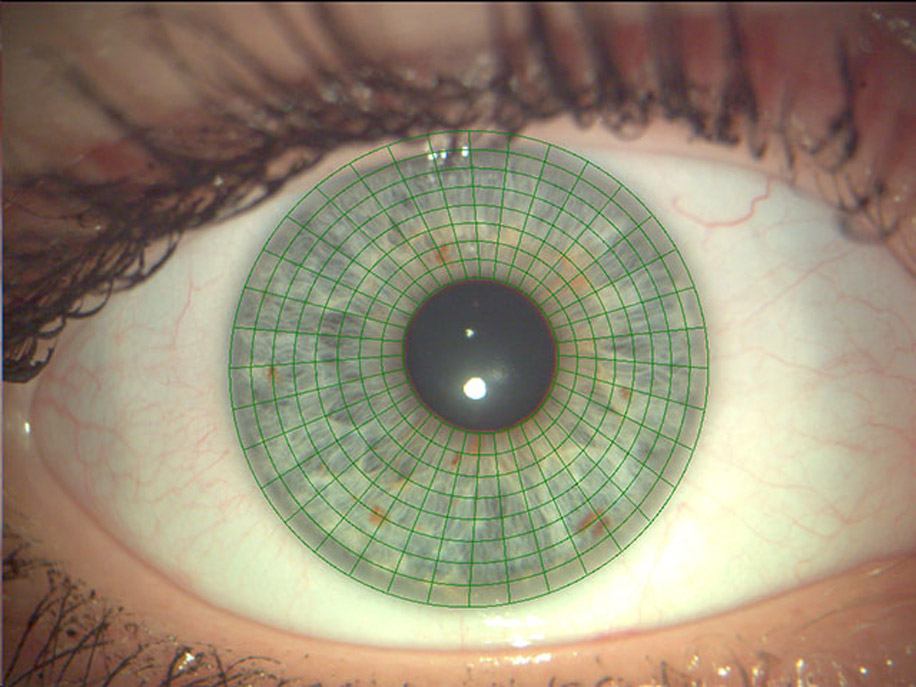
- Ретинография. Данный медицинский тест используется для получения детального цветного снимка внутренних структур глаза. С его помощью можно обнаружить различные заболевания, которые поражают сетчатку, таких, как ВМД, диабетическая ретинопатия или пигментный ретинит. Для проведения процедуры необходимо применить капли, расширяющие зрачок — мидриатики. Однако, современные ретинографы позволяют делать четкие и детальные снимки сетчатки без необходимости расширения зрачка. Такой метод называется немидриатическая ретинография.
- Автофлуоресценция. Неинвазивная техника получения снимков глазного дна. При возбуждении клеток ультрафиолетовым светом наблюдается собственная флуоресценция как белков, так и нуклеиновых кислот — так называемая автофлуоресценция. В данном случае индикатором выступает липофусцин — желто-коричневый пигмент, присутствующий во всех тканях человека. Его чрезмерное скопление в пигментном эпителии сетчатки является патогенной средой для многих ее патологий, в том числе и наследственного характера.
- Оптическая когерентная томография.
Этот способ позволяет получить максимально полные и точные данные о состоянии глаз. С его помощью можно осуществлять диагностику не только сетчатки, но и зрительного нерва, и переднего отрезка глаза. Разрешающая способность томографов настолько высока, что они позволяют получить снимки, в которых глазные структуры дифференцированы на уровне микрометров (тысячных долей миллиметра). ОКТ является одновременно и микроскопом, и сканером. На хорошем четком снимке, сделанном с помощью современного томографа, можно рассмотреть самые тонкие слои тканей толщиной в 1 мкм.
- Визуальная кампиметрия. Данный тест позволяет оценить состояние периферического зрения. Исследуются оба глаза отдельно, при этом второй должен быть закрыт. На кампиметре появляется мигающий полукруг различной интенсивности освещения в различных местах поля зрения исследуемого глаза, а пациенту следует указать на его расположение.
Кроме перечисленных, могут быть назначены дополнительные процедуры, позволяющие подтвердить точный диагноз — флюоресцентная ангиография, микропериметрия и прочие. После завершения исследований врач принимает решение о том, как воздействовать на пигментный ретинит.
Лечение заболевания
Один из хирургических способов приостановить течение пигментной ретинопатии — имплантация ксенотрансплантата за глазное яблоко. При этом возникает местное реактивное воспаление, которое способствует ускорению кровообращения в сосудах глазного яблока. Также нормализуется обмен веществ, метаболические процессы, устраняется локальная гипоксия сетчатки и зрительного нерва. Постепенное улучшение зрительных функций наступает в течение последующих 2 лет примерно у 30% пациентов. Хирургическое лечение с введением ксенотрансплантата имеет большую перспективу и может быть рекомендовано для лечения пигментного ретинита.
Улучшение зрения с помощью биоматериала «Аллоплант»
Всероссийский центр глазной и пластической хирургии — организация, которая занимается созданием препаратов и методов для лечения офтальмологических заболеваний. Одна из инновационных разработок Центра — биоматериал «Аллоплант», получаемый из донорских тканей человека или животных. Его использование помогает стимулировать процессы регенерации кровеносных и лимфатических сосудов, конъюнктивы, слизистых оболочек и других структур организма. За последние два десятка лет биоматериал был успешно применен для лечения ретинопатии недоношенных, диабетической ретинопатии, пигментного ретинита, атрофии и невритов зрительного нерва, увеита и других глазных патологий. Помимо этого, препарат используется в пластической хирургии, стоматологии, нейрохирургии, ортопедии, травматологии, гинекологии и других отраслях медицины.
При введении в сосудистую оболочку глаза «Аллопланта» он улучшает в ней кровообращение,что значительно улучшает состояние сетчатки. При исследовании на электронном микроскопе были выявлены признаки регенерации фоторецепторов и восстановление основной мембраны сетчатки — так называемой мембраны Бруха.
Недавно специалисты Центра глазной и пластической хирургии опубликовали результаты о применении препарата для 2000 пациентов с пигментным ретинитом. Если стадия заболевания была не терминальной (самой поздней), то приостановить ее развитие удавалось примерно в 75% случаев, а в 40% случаев удалось добиться расширения периферического поля и улучшения остроты зрения.
Достижения науки о лечении пигментного ретинита
К сожалению, кардинальных способов борьбы с этой наследственной патологией в настоящее время не существует. Однако во многих лабораториях мира ведутся активные исследования, связанные с данной темой. Ученые публикуют инновационные разработки, за которыми видят будущее в лечении пигментной ретинопатии.
Искусственная сетчатка
В 2017 году были обнародованы результаты работы Итальянского института технологий. Специалисты смогли разработать уникальный имплантат сетчатки, выполняющий ее функции. Он состоит из электропроводящего полимера с шелковой подложкой, завернутый в полимерный полупроводник. Когда световые лучи попадают на хрусталик, полупроводящий полимер срабатывает как фотоэлектрический материал, поглощая фотоны. Вырабатывается ток, и электричество стимулирует нейроны сетчатки.
Свое изобретение ученые проверили на крысах, вживив им искусственную сетчатку. Дальнейший эксперимент показал: при освещенности яркостью в 4-5 люксов, что соответствует сумеречному свету, мыши с искусственной сетчаткой реагируют на свет так же, как и здоровые особи. Проведенная спустя 10 месяцев томография выявила, что в зрительной коре мозга, отвечающей за визуальное восприятие, увеличилась активность.
Лечение пигментной ретинопатии стволовыми клетками
Еще один перспективный способ лечения заболеваний сетчатки предложили офтальмологи из США — восстановление структуры и функционирования светочувствительных рецепторов сетчатки с помощью геномного редактора CRISPR. Ученые использовали клетки кожи пациента с пигментным ретинитом, чтобы вырастить стволовые клетки. Им удалось заменить дефектный ген RGPR, не нарушив работу остальных генов, окружающих этот фрагмент ДНК. До стадии превращения стволовых клеток в палочки и колбочки ученые пока не дошли. Они отмечают, что, в отличие от традиционной пересадки органов, такой подход не вызовет отторжения иммунной системой.
Протез Argus II
Это устройство, известное также как бионический глаз, представляет собой электронный имплантат сетчатки, разработанный американскими инженерами. Его функция — улучшение зрения людей с тяжелой формой пигментного ретинита. В марте 2011 года применение имплантата было одобрено для клинического и коммерческого использования в Евросоюзе.
Бионический глаз способен восстановить уровень зрения функционально слепым пациентам. К марту 2014 года Argus II был установлен более чем 80 пациентам. Он не поднимает уровень зрения выше порога слепоты, но помогает значительно улучшить ориентацию в пространстве и мобильность. В некоторых случаях Argus II может восстановить достаточный зрительный функционал, чтобы позволить слепым пользователям читать буквы, набранные крупным шрифтом.
К импланту сетчатки, вживленному в глаз, также прилагается внешняя система: очки с камерой и процессором. Камера записывает изображения в реальном времени, которые обрабатываются и отправляются по беспроводной сети в имплантат. Имплантат использует 60 электродов, чтобы стимулировать имеющиеся здоровые клетки сетчатки и отправлять визуальную информацию в зрительный нерв, восстанавливая способность различать свет, движение и формы. В России было проведено уже две операции по вживлению бионического глаза пациентам.
Для профилактики наследственного пигментного ретинита больным рекомендуется защищать глаза от интенсивного солнечного света с помощью очков, а также при имеющейся генетической предрасположенности совершать регулярные визиты к офтальмологу для осмотра органов зрения. На начальных стадиях это заболевание никак себя не проявляет, а затем восстановить зрение может не быть возможности.
- Guardia, «La Médecine à travers les âges».
- З.С. Смирнова, Л.М. Борисова, М.П. Киселева и др. Доклиническое изучение противоопухолевой активности производного индолокарбазола ЛХС-1208 // Российский биотерапевтический журнал. 2014. № 1. С. 129.
- Мустафин Р. И., Буховец А. В., Протасова А. А., Шайхрамова Р. Н., Ситенков А. Ю., Семина И. И. Сравнительное исследование поликомплексных систем для гастроретентивной доставки метформина. Разработка и регистрация лекарственных средств. 2015; 1(10): 48–50.
- https://iz.ru/1137169/anna-urmantceva-mariia-nediuk/pro-zrenie-v-rossii-vyrastili-kletki-setchatki-vstraivaiushchiesia-v-glaza.
- https://www.ochkov.net/wiki/pigmentnaya-retinopatiya.htm.
- Ковнер, «Очерки истории M.».
- ОФС.1.2.1.2.0003.15 Тонкослойная хроматография // Государственная фармакопея, XIII изд.
- А.В. Ланцова, Е.В. Санарова, Н.А. Оборотова и др. Разработка технологии получения инъекционной лекарственной формы на основе отечественной субстанции производной индолокарбазола ЛХС-1208 // Российский биотерапевтический журнал. 2014. Т. 13. № 3. С. 25-32.
- Pund A. U., Shandge R. S., Pote A. K. Current approaches on gastroretentive drug delivery systems. Journal of Drug Delivery and Therapeutics. 2020; 10(1): 139–146. DOI: 10.22270/jddt.v10i1.3803.