Филиппова Е.О., Кривошеина О.И.
Эпителиально-эндотелиальная дистрофия (ЭЭД) роговицы занимает одну из лидирующих позиций среди причин корнеального слабовидения на территории Российской Федерации [1]. Согласно современным представлениям, значительную роль в развитии ЭЭД роговой оболочки играют первичные и вторичные процессы дистрофического и инфекционного характера, приводящие к гибели эндотелиоцитов, что приводит к нарушению функции эндотелиального слоя роговицы. При потере эндотелиальных клеток (менее 500 клеток на 1 мм2) увеличивается проницаемость роговой оболочки, жидкость диффундирует в строму, развивается хронический отек и образуются буллы на поверхности роговицы.
Несостоятельность барьерной функции эндотелиального слоя роговицы, по мнению ряда авторов, возникает в большинстве случаев вследствие хирургических вмешательств на переднем отрезке глаза [2-4]: в 1,2-14% после удаления катаракты с имплантацией чаще переднекамерной интраокулярной линзы (ИОЛ) и в 5,8% — после антиглаукомных операций. Факоэмульсификация способствует потере до 10% эндотелиальных клеток [5]. Объем потери эндотелиоцитов коррелирует с размером роговичного разреза, его расположением, степенью плотности катаракты, параметрами используемого ультразвука и объемом ирригационной жидкости, а также зависит от конкретной клинической ситуации.
Выбор лечебных мероприятий ЭЭД определяется стадией патологического процесса и в настоящее время проводится в двух направлениях: консервативном и хирургическом.
Задача фармакотерапии ЭЭД заключается в уменьшении хронического отека роговицы, купировании симптомов дискомфорта и улучшении зрительных функций. Консервативное лечение ЭЭД роговицы предусматривает применение различных кератопротективных, гиперосмотических, слезозамещающих, антиоксидантных средств, а также лечебных мягких контактных линз и лазерного излучения [6-9].
По некоторым данным, воздействие теплого воздуха в течение 5-10 минут после пробуждения способствует снижению отека эпителия [10] и может применяться в качестве физического метода, в дополнение к медикаментозной терапии. Антиоксиданты, антигипоксанты, витамины, биогенные пептиды, микроэлементы применяются в качестве стимуляторов обменных процессов в роговой оболочке [11, 12]. Имеются сведения о положительном эффекте ношения при ЭЭД гидрофильных контактных линз, действующих как эффективный прекорнеальный защитный слой и предохраняющих поврежденный эпителий от неблагоприятных факторов окружающей среды [13, 14]. Обязательным компонентом консервативного лечения ЭЭД роговицы является контроль уровня внутриглазного давления, так как его повышение способствует усилению отека на фоне прогрессирующего повреждения эндотелиального слоя роговицы [15].
Магнитно-инфракрасно-лазерная терапия, как метод консервативного лечения, широко применяется в клинической практике лечения ЭЭД, обладая противовоспалительным, иммуностимулирующим, десенсибилизирующим, бактерицидным и регенерирующим лечебным эффектом. К сожалению, она не обеспечивает стабильных клинико-функциональных результатов [16-18].
По мнению большинства исследователей, консервативное лечение ЭЭД эффективно только на ранних стадиях заболевания, при этом получаемый клинико-функциональный эффект является непродолжительным [19].
Патогенетически ориентированными методами лечения ЭЭД в настоящее время являются хирургические методы. Одним из наиболее распространённых оперативных вмешательств при данном заболевании является кератопластика [20]. Сквозная кератопластика — наиболее радикальный метод лечения ЭЭД роговицы, позволяющий добиться восстановления зрительных функций в 90% случаев. Получение качественного донорского материала, а также условия и порядок осуществления сквозной кератопластики регулируются законодательством РФ. Однако в настоящее время существует ряд нерешенных вопросов нормативно-правового регулирования процедуры забора тканей для трансплантации [21, 22], что в сочетании с высоким риском развития послеоперационных осложнений (присоединение вторичной инфекции, помутнение или отторжение трансплантата), длительным периодом реабилитации и вероятностью рецидива заболевания [23, 24] обусловливает поиск и разработку модифицированных способов сквозной кератопластики. Одним из таких методов является грибовидная кератопластика, впервые предложенная M. Busin в 2003 г. [25] и имеющая ряд преимуществ по сравнению со сквозной пересадкой роговицы, таких как надежная адаптация послеоперационной раны, сокращение сроков шовной фиксации и послеоперационной реабилитации, снижение риска индуцированного астигматизма. Согласно клиническим наблюдениям, у 96% пациентов, прооперированных данным способом, в послеоперационном периоде отмечается значительное улучшение зрительных функций (с исходных 0,014 до 0,3 — после операции) [26]. При этом величина астигматизма не превышает 4,48±2,14 дптр, а плотность эндотелиального слоя через 6 месяцев после оперативного вмешательства составляет 2436±354 клеток/мм2.
Однако грибовидная кератопластика характеризуется технической сложностью и требует существенных временных затрат [26]. В связи с этим, в 2008 г. I. Kaiserman и соавторы предложили упрощенный вариант данной операции — частичную обратную грибовидную кератопластику [27, 28].
В 1993 г. W. Ko и S. Feldman в эксперименте впервые изучили возможность замены дистрофически измененного эндотелиального слоя роговицы донорским трансплантатом только задних отделов роговой оболочки [29]. В дальнейшем эти исследования послужили основой для развития задней послойной кератопластики — Posterior lamellar keratoplasty (PLK) и Deep lamellar endothelial keratoplasty (DLEK), предложенной Mark Terry в 2001 г. [30]. Суть операции заключается в том, что с помощью трепана, введенного в предварительно расслоенную роговицу реципиента на уровне 2/3 стромы через лимбальный разрез 9 мм, удаляются задние слои роговой оболочки. Далее, заранее приготовленный донорский трансплантат роговицы в сложенном состоянии вводится с помощью инжектора в переднюю камеру, помещается в созданное роговичное ложе и фиксируется в нем посредством стерильного воздуха.
О.Г. Оганесян и соавт. [31], апробируя метод DLEK, указывают на высокую эффективность эндотелиальной хирургии при поражениях заднего эпителия роговой оболочки. Достоинством операции являются низкая частота дислокаций трансплантата, относительно предсказуемый рефракционный результат, отсутствие негативного влияния придаточного аппарата глаза на трансплантат и послеоперационную рану, что обеспечивает значительное преимущество DLEK перед сквозной кератопластикой. Тем не менее, после DLEK или PLK в послеоперационном периоде возможно развитие таких осложнений, как полная отслойка (2%) или частичная отслойка трансплантата (16%), несостоятельность его эндотелия (5,6%), реакция отторжения (7%).
F. Priceс соавторами в 2005 г. была предложена методика эндотелиальной кератопластики с отслаиванием десцеметовой мембраны — Descemet’s stripping endothelial keratoplasty, более известная в отечественной литературе, как DSEK [32]. При ней предварительно отслоенная с помощью трепана десцеметова мембрана удаляется вместе с пораженным эндотелием. Зона удаляемого участка роговицы имеет форму диска диаметром 8-9 мм. Затем в роговичное ложе помещается предварительно полученный аналогичного диаметра гомотрансплантат задних слоев стромы роговой оболочки донора и фиксируется к внутренней поверхности роговицы с помощью стерильного воздуха. Однако, помимо положительных клинических результатов (улучшение зрительных функций, уменьшение отека роговицы), в послеоперационном периоде имеется высокий — до 50% — риск отслойки и дислокации трансплантата.
В.Р. Мамиконян и С.В. Труфанов [33] отмечают высокую клинико-функциональную эффективность DSEK и DSАEK при лечении буллезной кератопатии. Согласно их данным, случаи тканевой несовместимости после таких операций не превышают 8,5±4,5%, величина послеоперационного астигматизма составляет 1,07±1,38 дптр, задержка эпителизации наблюдается в 19% случаев, офтальмогипертензия в раннем послеоперационном режиме — в 11%, что свидетельствует об относительной безопасности и значительной эффективности данного вида хирургического вмешательства.
В 2006 г. M. Gorovoy модифицировал DSEK, предложив использовать автоматизированный микротом в целях создания равномерного и контролированного по глубине среза роговичного трансплантата. Операция получила название автоматизированная эндотелиальная кератопластика с отслаиванием десцеметовой мембраны — Descemet’s stripping automated endothelial keratoplasty (DSAEK) [34]. В 2006 г. группой ученых во главе с G.Melles опубликованы результаты успешной клинической апробации метода трансплантации десцеметовой мембраны — Descemet’s membrane endothelial keratoplasty (DMEK). Согласно представленным данным, в послеоперационном периоде у пациентов наблюдаются высокие клинико-функциональные результаты: через месяц после операции повышение остроты зрения до 0,7 отмечено у 43% пациентов, через 6 месяцев — у 71% [35]. Однако, значительная техническая сложность операции, высокий риск отслоения трансплантата (до 30%) и эффективность вмешательства преимущественно на начальных стадиях ЭЭД препятствует широкому распространению данной операции в офтальмохирургической практике.
Микроинвазивная десцеметопластика [36], как одно из направлений эндотелиальной хирургии роговицы, имеет неоспоримые преимущества в хирургическом лечении ЭЭД роговицы, так как позволяет не только добиться высоких зрительных функций и восстановить прозрачность роговой оболочки до 90% случаев, но и заметно сократить риск послеоперационных осложнений. Однако, как и в случае с DMEK, способ не нашел широкого распространения в силу его определенной технической сложности.
В 2007 г. сингапурскими офтальмологами во главе с J.S. Mehta был разработан метод введения эндотелиального трансплантата при помощи инструмента Glide и пинцета для капсулорексиса. Согласно результатам экспериментальных исследований in vitro, потеря эндотелиоцитов донорского трансплантата при использовании предложенной методики не превышала 9%. Однако, по данным клинической апробации, данный показатель составил 26% [37].
Отдельное направление в хирургическом лечении ЭЭД роговицы связано с использованием трансплантации амниотической мембраны. Первые результаты применения мембраны амниона в лечении буллезной кератопатии показали его высокую эффективность при эндотелиальной дисфункции. По данным ряда авторов [38, 39], уже на 2 сутки после интрастромальной трансплантации амниотической мембраны наблюдается купирование болевого и роговичного синдромов, улучшение зрительных функций за счет снижения отечности роговой оболочки и количества булл. Однако, несмотря на эффективность кератопластики с применением амниона в лечении ЭЭД роговицы, единого мнения относительно техники трансплантации и параметров трансплантируемого материала до настоящего времени не существует.
Выводы
Проблема лечения ЭЭД на сегодняшний день остается одной из наиболее актуальных в современной офтальмологии. Выбор тактики лечения определяется поиском баланса между клинико-патогенетической эффективностью и риском развития послеоперационных осложнений и должен решаться в каждом случае индивидуально, учитывая стадию заболевания и общесоматический фон пациента.
Эндотелиальная дистрофия роговицы (Дистрофия Фукса)
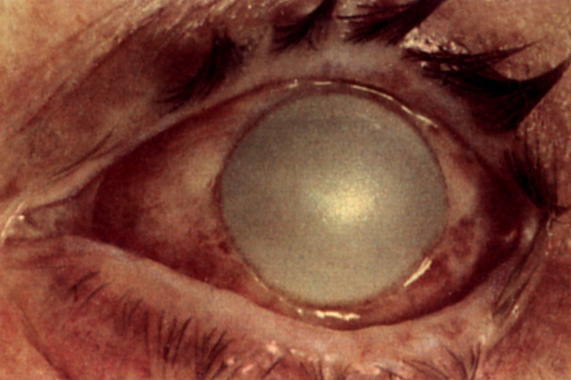
Эндотелиальная дистрофия роговицы — это заболевание органа зрения, причиной которого является отмирание клеток заднего эпителия роговой оболочки. Клинически проявляется снижением остроты зрения в утреннее время, фотофобией, гиперемией, повышенным слезотечением, болевым синдромом. Диагностика эндотелиальной дистрофии роговицы включает в себя проведение наружного осмотра, конфокальной микроскопии, биомикроскопии, пахиметрии, визометрии. Симптоматическая терапия основывается на инстилляции гипертонических солевых растворов. Хирургическая тактика — проведение сквозной или послойной кератопластики.
Общие сведения
Эндотелиальная дистрофия роговицы, или дистрофия Фукса — это патологическое состояние в офтальмологии, характеризующееся нарушением трофики с последующей дегенерацией роговой оболочки. Первое описание первичной эндотелиальной дистрофии роговицы было представлено австрийским ученым Э. Фуксом в начале ХХ века. Исследователь считал, что патология развивается вследствие нарушения регионального кровоснабжения или иннервации, гормонального дисбаланса.
Заболевание может быть первичным или вторичным, ранним или поздним. При раннем варианте эндотелиальную дистрофию роговицы можно диагностировать у детей до 3 лет. Клиника позднего варианта наблюдается у пациентов в возрасте старше 45 лет. Ранние дистрофии с одинаковой частотой встречаются среди мужчин и женщин. Поздняя форма заболевания более распространена среди лиц женского пола.
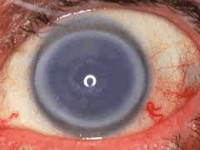
Эндотелиальная дистрофия роговицы
Причины
Первичная эндотелиальная дистрофия роговицы — это генетически детерминированное заболевание. Установлен аутосомно-доминантный тип наследования с неполной или высокой пенетрантностью. При ранней форме возникает мутация гена COL8A2, при поздней — SLC4A11 или ZEB1. В то же время, у 50% пациентов болезнь развивается спорадически.
Реже триггером выступает дисфункция митохондрий эндотелиоцитов, что ведет к их недостаточности. Патологический процесс локализируется во внутреннем слое роговой оболочки, эндотелиоциты которого в последующем не могут делиться и регенерировать. Этиологической роли факторов внешней среды и системных патологий в развитии данного заболевания не установлено.
Наиболее распространённая причина возникновение вторичной эндотелиальной дистрофии роговицы — травматическое повреждение органа зрения. Ятрогенный фактор реализуется при проведении оперативного вмешательства. Хроническое течение кератита при отсутствии своевременного лечения способствует дегенерации роговой оболочки, что обусловлено повреждением эндотелия. При данной патологии воспалительный процесс является не этиологическим фактором, а лишь предпосылкой к развитию эндотелиальной дистрофии роговицы у генетически скомпрометированных лиц.
Патогенез
Компенсаторная гиперфункция эндотелиоцитов при прогрессировании заболевания не может обеспечить выведение избытка жидкости и поддержание прозрачности роговицы. Это связано с пропотеванием водянистой влаги передней камеры глаза через дефекты в эндотелии в строму роговой оболочки. Выраженная отечность приводит к эндотелиальной дистрофии роговицы. При распространении отека на наружный слой возникает буллезная кератопатия. Проведение оперативных вмешательств на роговой оболочке в связи с выраженным истончением эндотелия часто осложняется отеком, что усугубляет деструктивные процессы.
Симптомы дистрофии роговицы
С клинической точки зрения выделяют первичную и вторичную формы дистрофии Фукса. Первичное поражение роговой оболочки является врождённым. Первые проявления ранней дистрофии обнаруживаются при рождении или в раннем детском возрасте, но этот тип заболевания встречается крайне редко. Поздний вариант первичной эндотелиальной дистрофии Фукса чаще развивается у лиц после 45 лет. Для данного типа патологии характерно бинокулярное, но асимметричное течение. Вторичная дистрофия — это приобретённое заболевание, при котором наблюдается монокулярное поражение.
В зависимости от степени тяжести патологии клиника эндотелиальной дистрофии роговицы может характеризоваться латентным течением или проявлениями буллезной кератопатии. Симптомы заболевания медленно прогрессируют, поэтому с момента появления первых признаков до формирования развернутой клинической картины может пройти около 20 лет.
Первая стадия
На первой стадии эндотелиальной дистрофии роговицы морфологические изменения затрагивают только центральные отделы роговой оболочки. При этом появляются специфические коллагеновые образования (гутты) каплевидной, бородавчатой и грибовидной формы. Жалобы отсутствуют. Единственным симптомом заболевания является незначительное снижение остроты зрения в утреннее время.
Вторая стадия
На второй стадии количество эндотелиоцитов уменьшается, развивается отек роговицы, появляются одиночные буллы. Ощущение инородного тела сменяется снижением чувствительности роговой оболочки из-за дегенерации нервных окончаний. Специфические симптомы этой стадии эндотелиальной дистрофии роговицы представлены фотофобией, гиперемией глаз, снижением остроты зрения в утреннее время с последующим восстановлением к вечеру. Это связано с тем, что из-за сомкнутых глаз в период сна должным образом не осуществляется испарение влаги с роговой оболочки, что приводит к депонированию жидкости. Днем испарение влаги способствует уменьшению отечности и возобновлению зрительных функций.
Длительное течение эндотелиальной дистрофии роговицы становится причиной медленно прогрессирующего снижения остроты зрения. При распространении патологического процесса на эпителиальный слой и появлении буллезных изменений пациенты предъявляют жалобы на ощущение инородного тела и повышенную слезоточивость. Болевой синдром, сопровождающийся сильным дискомфортом в области глазницы, развивается при разрыве булл у больных с буллезной кератопатией.
Третья стадия
На третьей стадии вдоль эпителия базальной мембраны синтезируется фиброзная ткань с последующим формированием паннуса. Общее состояние при этом несколько улучшается, но прогрессирование эндотелиальной дистрофии роговицы в дальнейшем приводит к появлению эпителиальных эрозий, язв микробного генеза и васкуляризации центральной части роговой оболочки.
Диагностика
Диагностика эндотелиальной дистрофии роговицы основывается на результатах наружного осмотра, специальных офтальмологических исследований и генодиагностики. При наружном осмотре выявляется помутнение роговицы, возможна конъюнктивальная инъекция сосудов. Решающие данные получают с помощью:
- Конфокальной микроскопии роговицы. Является золотым стандартом в диагностике данной патологии. Помимо детального изображения эндотелия, измеряется плотность клеток и их средний диаметр на единицу площади. Степень снижения размера и количества клеточных элементов при эндотелиальной дистрофии роговицы зависит от тяжести заболевания. Также выявляются специфические образования (гутты) в виде капель темного цвета с яркой центральной частью и околоклеточной локализацией. В начале развития диметр гутты меньше эндотелиоцита, в последующем они сливаются и имеют вид крупных пятен.
- Биомикроскопии. При проведении биомикроскопии со щелевой лампой визуализируются локальные зоны дегенерации эндотелиального слоя, отечность. При распространении отека на наружный слой определяются специфические буллы на поверхности роговой оболочки, что указывает на развитие буллезной кератопатии.
- Пахиметрии. Методом пахиметрии определяют толщину роговой оболочки. Дегенеративные процессы при эндотелиальной дистрофии роговицы приводят к ее истончению (менее 0,49 мм), но при появлении отека ее толщина может превышать референсные значения (0,56 мм).
- Визометрии. При помощи визометрии измеряется степень снижения остроты зрения. Для получения достоверного результата и косвенного определения степени выраженности отека пациентам с эндотелиальной дистрофией роговицы рекомендовано проводить исследования в утреннее и вечернее время.
Лечение эндотелиальной дистрофии роговицы
Консервативная тактика
Симптоматическая терапия эндотелиальной дистрофии роговицы включает в себя проведение инстилляций гипертонических солевых растворов с целью уменьшения отечности. Выведение с роговой оболочки избыточной жидкости улучшает остроту зрения. С целью купирования болевого синдрома показан пероральный прием анальгетиков или их инстилляция. Для коррекции остроты зрения можно использовать только мягкие контактные линзы или очки. Также в лечении эндотелиальной дистрофии роговицы применяется роговичный кросс-линкинг, в основе которого лежит фотополимеризация волокон стромы при помощи совместного воздействия фотосенсибилизирующего препарата и ультрафиолетового излучения.
Хирургическое лечение
Тяжелое течение эндотелиальной дистрофии роговицы, сопровождающееся выраженным снижением остроты зрения, сильным истончением роговицы по данным пахиметрии и низкой плотностью клеток на единицу площади по результатам конфокальной микроскопии, является показанием к проведению кератопластики. Сквозной вариант хирургического вмешательства показан при тотальном дистрофическом процессе. Послойная кератопластика рекомендована пациентам в случае повреждения одного или нескольких слоев роговой оболочки. При этом зачастую выполняется трансплантация десцеметовой мембраны совместно с эндотелием.
Прогноз и профилактика
Прогноз при ранней диагностике и лечении для жизни и трудоспособности благоприятный. Отсутствие терапии может привести к полной утрате зрения и инвалидизации пациента. Специфических мер по профилактике эндотелиальной дистрофии роговицы не разработано, поскольку заболевание генетически детерминированное. Неспецифические превентивные меры сводятся к предупреждению травматических повреждений у генетически скомпрометированных лиц, скринингу у новорожденных, своевременной диагностике и лечению офтальмологической патологии. Всем пациентам с установленным диагнозом эндотелиальная дистрофия роговицы необходимо 2 раза в год проходить обследование у офтальмолога.
- М.П. Киселева, З.С. Смирнова, Л.М. Борисова и др. Поиск новых противоопухолевых соединений среди производных N-гликозидов индоло[2,3-а] карбазолов // Российский онкологический журнал. 2015. № 1. С. 33-37.
- Moustafine R. I., Bobyleva V. L., Bukhovets A. V., Garipova V. R.,Kabanova T. V., Kemenova V. A., Van den Mooter G. Structural transformations during swelling of polycomplex matrices based on countercharged (meth)acrylate copolymers (Eudragit® EPO/Eudragit® L 100-55). Journal of Pharmaceutical Sciences. 2011; 100:874–885. DOI:10.1002/jps.22320.
- Скориченко, «Доисторическая M.» (СПб., 1996); его же, «Гигиена в доисторические времена» (СПб., 1996).
- https://eyepress.ru/article.aspx?23883.
- https://www.KrasotaiMedicina.ru/diseases/ophthalmology/endothelial-dystrophy.
- Frédault, «Histoire de la médecine» (П., 1970).