Семейно-наследственная дистрофия роговицы
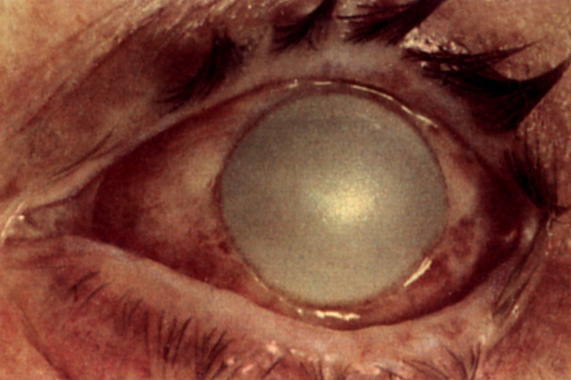
Первичные дистрофии роговицы обычно двусторонние. Среди них основное место занимают семейно-наследственные дегенерации. Заболевание начинается в детском или юношеском возрасте, очень медленно прогрессирует, вследствие чего в течение длительного периода времени может оставаться незамеченным. Чувствительность роговицы постепенно снижается, отсутствуют признаки раздражения глаза и воспалительные изменения. При биомикроскопическом исследовании сначала выявляют очень нежные помутнения в центральном отделе роговицы, имеющие вид мелких узелков, пятен или полосок. Патологические включения в роговице чаще всего располагаются в поверхностных слоях стромы, иногда субэпителиально. Передний и задний эпителий, а также эластические мембраны роговицы не изменяются. Периферические отделы роговицы могут оставаться прозрачными, новообразованных сосудов нет. К 30-40 годам снижение зрения становится заметным, начинает изменяться эпителий роговицы. Периодическое слушивание эпителия вызывает болевые ощущения, светобоязнь, блефароспазм.
Различные виды наследственных дистрофий роговицы отличаются друг от дуга в основном формой и расположением очаговых изменений в роговице. Известны узелковые, пятнистые, решетчатые и смешанные дистрофии. Наследственный характер этих заболеваний установлен в начале прошлого века.
В Украине и России эта патология встречается редко (реже, чем в других европейских странах).
Лечение семейно-наследственных дистрофий симптоматическое. Назначают витаминные капли и мази, препараты, улучшающие трофику роговицы: баларпан, тауфон, адгелон, эмоксипин, этаден, ретинол, гель солкосерила, актовегин; внутрь принимают поливитамины. Консервативное лечение не останавливает прогрессирование заболевания. При значительном снижении зрения проводят послойную или сквозную кератопластику. Лучший оптический результат дает сквозная пересадка роговицы. Семейно-наследственная дистрофия — единственный вид патологии роговицы, который возобновляется в донорском трансплантате. Спустя 5-7 лет после операции в прозрачном трансплантате по периферии появляются единичные узелки или полосочки нежных помутнений, такие же, какие были в собственной роговице. Количество их медленно увеличивается, постепенно ухудшается зрение. Через 10- 15 лет приходится производить повторную пересадку роговицы, которая в большинстве случаев хорошо приживает, обеспечивая высокую остроту зрения.
[8], [9], [10], [11], [12], [13], [14], [15], [16], [17]
Эпителиальная (эндотелиальная) дистрофия роговицы
Эпителиальная (эндотелиальная) дистрофия роговицы (синонимы: отечная, эпителиально-эндотелиальная, эндотелиально-эпителиальная, буллезная, глубокая дистрофия) может быть как первичной, так и вторичной. Долгое время причина этого заболевания оставалась неизвестной. В настоящее время ни у кого не вызывает сомнений тот факт, что первичная отечная дистрофия роговицы возникает при несостоятельности барьерной функции однорядного слоя клеток заднего эпителия, вызванной дистрофическими изменениями в клетках, либо критически малым их количеством (менее 500-700 клеток в 1 мм2).
Зеркальная биомикроскопия позволяет выявить тонкие начальные изменения, когда роговица еще прозрачна и нет отека. Их можно диагностировать и при обычной биомикроскопии, если внимательно осмотреть заднюю поверхность роговицы в тонком световом срезе. В норме клетки заднего эпителия роговицы не видны, поскольку они очень малы. Когда количество клеток значительно уменьшается, оставшиеся клетки уплощаются и растягиваются, чтобы закрыть всю заднюю поверхность роговицы. Размеры клеток увеличиваются в 2-3 раза, поэтому их уже можно увидеть при биомикроскопии. Задняя поверхность роговицы становится похожей на запотевшее стекло. Этот феномен называют капельной роговицей (cornea guttata). В настоящее время нет способов радикально изменить это состояние, однако ранняя диагностика предвестников надвигающейся болезни позволяет правильно спланировать лечение сопутствующей патологии, например выбрать метод экстракции катаракты, наиболее щадящий заднюю поверхность роговицы, отказаться от введения искусственного хрусталика (или найти нужную модель) и, что очень важно, поручить выполнение операции самому опытному хирургу. Исключив или уменьшив травму клеток заднего эпителия роговицы, удается отодвинуть на несколько месяцев или лет развитие отечной дистрофии.
Наличие симптома капельной роговицы еще не означает начала заболевания (роговица прозрачна и неутолщена), но является свидетельством того, что функциональные возможности клеток заднего эпителия роговицы близки к предельным. Достаточно потери небольшого количества клеток, чтобы образовались незакрывающиеся дефекты. Этому могут способствовать инфекционные заболевания, контузии, травмы, особенно полостные операции.
В тех случаях, когда между клетками заднего эпителия роговицы появляются щели, внутриглазная жидкость начинает пропитывать строму роговицы. Отек постепенно распространяется от задних слоев на всю роговицу. Толщина ее в центре может увеличиться почти в 2 раза. При этом значительно снижается острота зрения из-за того, что жидкость раздвигает роговичные пластины, в результате чего нарушается их строгая упорядоченность. Позднее отечная дистрофия распространяется и на передний эпителий роговицы. Он становится шероховатым, вздувается в виде пузырьков различного размера, которые легко отслаиваются от боуменовой мембраны, лопаются, обнажая нервные окончания. Появляется выраженный роговичный синдром: боль, ощущение инородного тела, светобоязнь, слезотечение, блефароспазм. Следовательно, дистрофия переднего эпителия является завершающей стадией отечной дистрофии роговицы, которая всегда начинается с задних слоев.
Состояние слоя клеток заднего эпителия роговицы обычно одинаковое в обоих глазах. Однако отечная дистрофия роговицы развивается сначала в том глазу, который подвергался травме (бытовой или хирургической).
Лечение отечной дистрофии роговицы вначале симптоматическое. Назначают противоотечные препараты в инстилляциях (глюкозу, глицерин), а также витаминные капли и средства, улучшающие трофику роговицы (баларпан, глекомен, карнозин, тауфон). Когда отечность достигает эпителия роговицы, обязательно добавляют антибактериальные средства в виде капель и мазей, а также масляный раствор токоферола, гель солкосерила, актовегина, витаминные мази, улучшающие регенерацию эпителия. Мазевые препараты и лечебные контактные линзы служат своеобразной повязкой для роговицы, защищают открытые нервные окончания от внешних раздражений, снимают болевые ощущения.
Хороший лечебный эффект дает низкоэнергетическая лазерная стимуляция роговицы расфокусированным лучом гелий-неонового лазера.
Консервативное лечение обеспечивает только временный положительный эффект, поэтому его периодически повторяют по мере ухудшения состояния роговицы.
Радикальным способом лечения является сквозная субтотальная кератопластика. Донорский трансплантат в 70-80 % случаев остается прозрачным, обеспечивает возможность улучшения остроты зрения и оказывает лечебное воздействие на оставшийся отечный ободок собственной роговицы, который может быть полупрозрачным, но поверхность его становится гладкой, отек проходит. Уже через 1-2 мес роговицы донора и реципиента’ имеют одинаковую толщину.
Длительно существующая эпителиальная (эндотелиальная) дистрофия роговицы, как правило, сочетается с дистрофическими изменениями в сетчатке, поэтому даже при идеальной прозрачности донорского трансплантата нельзя рассчитывать на максимально высокую остроту зрения: она бывает в пределах 0,4-0,6.
Вторичная эпителиальная (эндотелиальная) дистрофия роговицы возникает как осложнение глазных полостных операций, травм или ожогов.
Клинические проявления первичной и вторичной отечной дистрофии роговицы очень схожи, но имеются и существенные отличия. Обычно заболевает один глаз. Всегда прослеживается первопричина возникшего отека — бытовая, производственная или хирургическая травма. Главное отличие состоит в том, что отек роговицы возникает на ограниченном участке соответственно месту контакта с травмирующим агентом, а вокруг этого участка находятся здоровые клетки заднего эпителия роговицы, способные к замещению дефекта.
Через дефект в слое клеток заднего эпителия в строму роговицы проникает внутриглазная жидкость. Локальный отек постепенно доходит до поверхностных слоев и переднего эпителия. В тех случаях, когда патологический очаг находится не в центре роговицы, острота зрения может снижаться незначительно. При появлении буллезной дистрофии переднего эпителия возникает раздражение глазного яблока в секторе патологического очага, боль, светобоязнь, слезотечение и блефароспазм.
Лечение такое же, как и при первичной дистрофии роговицы. Отек начинает уменьшаться через 7- 10 дней, когда заживает рана роговицы. При вторичной форме дистрофии возможны полное заживление очага поражения и исчезновение отека. Для этого требуется разный период времени — от одного до нескольких месяцев в зависимости от плотности клеток и площади повреждения заднего эпителия, а также от скорости заживления общей раны роговицы.
В том случае, если инородное тело, например опорный элемент искусственного хрусталика, периодически касается задней поверхности роговицы, то отек увеличивается, усиливаются болевые ощущения, несмотря на любые лечебные меры. В этом случае нужно либо зафиксировать хрусталик (подшить к радужке), либо удалить, если его конструкция несовершенна.
Фиксированный (постоянный) контакт опорного элемента хрусталика не вызывает отечной дистрофии роговицы и не требует его устранения, если для этого нет других причин. При фиксированном контакте, когда опора хрусталика заключена в рубце роговицы и радужки, больше не возникают новые повреждения заднего эпителия роговицы в отличие от ситуации с периодически повторяющимися контактами.
Вторичная отечная дистрофия роговицы может возникнуть в глазу с искусственным хрусталиком, где нет контакта тела линзы или ее опорных частей с роговицей. В этом случае удаление хрусталика не дает лечебного эффекта, а, наоборот, будет дополнительной травмой для больной роговицы. Не следует «наказывать» хрусталик, если он «не виноват» в возникновении отека роговицы. В этом случае причину вторичной отечной дистрофии нужно искать в травматичности самой операции.
Под воздействием приведенных выше лечебных мероприятий может наступить выздоровление, однако на месте отека всегда остается более или менее плотное помутнение. В тяжелых случаях, когда отечная дистрофия захватывает всю роговицу или ее центр и консервативная терапия долго не дает положительного результата, производят сквозную субтотальную кератопластику, но не ранее чем через 1 год после операции или травмы глаза. Чем меньше утолщена роговица, тем больше надежды на благоприятный исход операции.
[18], [19], [20], [21], [22], [23], [24]
Лентовидная дистрофия (дегенерация) роговицы
Лентовидная дистрофия (дегенерация) роговицы — это медленно нарастающее поверхностное помутнение в слепых или слабовидящих глазах.
Лентовидная дистрофия роговицы развивается спустя несколько лет после тяжелых иридоциклитов, хориоидитов в глазах, ослепших вследствие глаукомы или тяжелых травм. Помутнения возникают на фоне измененной чувствительности роговицы, уменьшения подвижности глазного яблока и снижения обменных процессов в глазу. При нарастающей атрофии мышечного аппарата появляются непроизвольные движения глазного яблока (нистагм). Помутнения располагаются поверхностно в области боуменовой оболочки и переднего эпителия. Строма роговицы и задние слои остаются прозрачными. Изменения начинаются на периферии роговицы у внутреннего и наружного краев и, медленно нарастая, перемещаются к центру в пределах открытой глазной щели в виде горизонтально расположенной ленты. Сверху, где роговица прикрыта веком, она всегда остается прозрачной. Помутнения распределяются неравномерно, могут быть островки прозрачной поверхности роговицы, но с течением времени они тоже закрываются. Для лентовидной дегенерации характерно отложение известковых солей, поэтому поверхность роговицы становится сухой и шероховатой. При большой давности таких изменений тонкие пластинки ороговевшего эпителия, пропитанного солями, могут самостоятельно отторгаться. Возвышающиеся солевые выросты травмируют слизистую оболочку века, поэтому их необходимо удалить.
Грубые помутнения и солевые отложения в роговице образуются на фоне выраженных общих трофических изменений в слепом глазу, которые могут приводить к субатрофии глазного яблока. Известны случаи, когда известковые отложения формировались не только в роговице, но и по ходу сосудистого тракта глаза. Происходит окостенение хориоидеи.
Такие глаза подлежат удалению с последующим косметическим протезированием. В глазах с остаточным зрением производят поверхностную кератэктомию (срезание мутных слоев) в пределах оптической зоны роговицы (4-5 мм). Обнаженная поверхность покрывается эпителием, нарастающим с неповрежденного верхнего отдела роговицы, и может в течение нескольких лет оставаться прозрачной, если больной регулярно закапывает капли, поддерживающие трофику роговицы, и закладывает мази, препятствующие ороговению эпителия.
Лентовидная дистрофия роговицы у детей, сочетающаяся с фибринозно-пластическим иридоциклитом и катарактой, характерна для болезни Стилла (синдром Стилла). Кроме триады глазных симптомов, отмечаются полиартрит, увеличение печени, селезенки, лимфатических желез. После курса противовоспалительного лечения по поводу иридоциклита производят экстракцию катаракты. Когда помутнения в роговице начинают закрывать центральную зону, принимают решение о выполнении кератэктомии. Лечение основного заболевания проводит терапевт.
Краевая дистрофия (дегенерация) роговицы
Краевая дистрофия (дегенерация) роговицы обычно возникает на двух глазах, развивается медленно, иногда в течение многих лет. Роговица истончается около лимба, образуется серповидный дефект. Неоваскуляризация отсутствует или выражена незначительно. При выраженном истончении роговицы нарушается ее сферичность, снижается острота зрения, появляются участки эктазии, в связи с чем появляется угроза возникновения перфораций. Обычное медикаментозное лечение дает лишь временный эффект. Радикальным методом лечения является краевая послойная пересадка роговицы.
[25]
Клинико-генетические аспекты наследственных дистрофий роговицы
Малюгин Б.Э., Антонова О.П.
Последние два десятилетия характеризуются прорывом в идентификации генетических основ многих заболеваний человека. Что касается глазных болезней, то наиболее значимый прогресс был достигнут в изучении наследственных дистрофий сетчатки. Тем не менее, к настоящему моменту генетически верифицированы также и многие из заболеваний роговицы. В 2008 г. был создан Международный комитет по классификации дистрофий роговицы (IC3D) [26], после чего совместными усилиями нескольких групп исследователей картированы гены, участвующие в нормальном развитии роговицы, определены генетические мутации, обусловливающие манифестацию наследственных дистрофий роговицы и типы их наследования. В данной статье будут рассмотрены наследственные дистрофии роговицы в свете имеющихся на настоящий момент представлений о клинико-генетической взаимосвязи их развития и течения.
Дистрофии роговицы представляют собой весьма гетерогенную группу двусторонних генетически детерминированных заболеваний невоспалительной природы [24]. Их клиническая картина достаточно подробно изучена. Тем не менее, в повседневной практике корректный диагноз конкретному пациенту выставляется далеко не всегда. Так, нередко одно и то же заболевание описывается клиницистами под разными наименованиями или, напротив, под единым диагнозом объединяют подчас весьма далекие по патогенезу формы. Представленная ситуация зависит не только от объема знаний конкретного специалиста, но объективно связана с выраженным клиническим полиморфизмом и генетической гетерогенностью наследственных дистрофий роговицы, что и приводит к трудностям дифференциальной диагностики отдельных их форм.
Клинически дистрофии роговицы классифицируются с позиций поражения её гистологических слоев. Как правило, они разделяются на три группы в зависимости от глубины залегания патологического процесса [1, 2, 13]. Так, к «передним», или поверхностным, дистрофиям принято относить те, которые поражают в первую очередь эпителий роговицы и базальную мембрану (Боумена), в случае стромальных дистрофий очаг поражения локализуется непосредственно в строме роговицы, при эндотелиальных, или так называемых «задних» дистрофиях, в патологический процесс вовлечена десцеметова мембрана с прилегающим монослоем эндотелиальных клеток роговицы [1, 2, 20].
В группе «передних» дистрофий роговицы наиболее часто встречается микрокистозная дистрофия Когана (дистрофия передней базальной мембраны). Данная патология наследуется по аутосомно-доминантному типу и обусловлена мутациями в гене TGFB1 на хромосоме 5q31. Экспрессия представленного гена приводит к образованию «избыточной» базальной мембраны Боумена, которая вдается в эпителий, что вызывает формирование множественных базальных мембран в роговичном эпителии. Вовлеченные эпителиальные клетки формируют микроцисты Когана, которые биомикроскопически характеризуют как помутнения в виде сероватых линий, «отпечатков пальцев», в виде линий и точек (микрокисты), которые могут быть солитарными либо в комбинации с другими элементами. Зачастую изложенные гистологические изменения имеют асимптоматичное течение, что затрудняет определение точных сроков манифестации заболевания. В некоторых случаях развиваются рецидивирующие эрозии эпителия роговицы [4, 5].
Редко встречающейся двусторонней патологией передних слоев роговицы является ювенильная эпителиальная дистрофия Мисмана. На сегодняшний день описаны 2 генетических варианта заболевания с аутосомно-доминантным типом наследования, обусловленных мутациями в генах KRT3 на хромосоме 12q13 и KRT12 на хромосоме 17q12. Как правило, данный тип наследственной дистрофии роговицы манифестирует в первые 5 лет жизни ребенка и клинически проявляется редким обострением классического роговичного синдрома (светобоязнь, слезотечение, блефароспазм, перикорнеальная инъекция). Биомикроскопически дистрофия роговицы Мисмана выражается в появлении прозрачных эпителиальных кист и утолщении базальной мембраны Боумена. Заболевание крайне редко прогрессирует и в большинстве случаев не приводит к значимому снижению остроты зрения [6, 9, 23].
Клинически сложно дифференцируемой от выше представленной патологии является эпителиальная дистрофия роговицы Лиша. Первые симптомы также появляются в раннем детском возрасте. Описанные выше эпителиальные кисты имеют тенденцию к слиянию, образуя при этом сероватые легкие помутнения в виде завитков или решетки. Прогрессирование патологического процесса приводит к рецидивирующим эрозиям. Генетические исследования заболевания определили Х-сцепленный рецессивный тип наследования. Ген картирован на хромосоме Хр22.3 и на сегодняшний день не идентифицирован [7, 17].
К «передним» редким наследственным дистрофиям роговицы также относится дистрофия Рейс-Баклера, наследуемая по аутосомно-доминантному типу и обусловленная мутациями в гене TGFB1 на хромосоме 5q31. Для данной дистрофии роговицы характерно появление острых рецидивирующих эрозий с ранних лет, иногда сразу после рождения. Патологические изменения боуменовой мембраны из-за сетчатых кольцевидных субэпителиальных помутнений, наиболее плотных в центральной зоне, напоминают структуру медовых сот. Прогрессирование заболевания приводит к снижению остроты зрения, что чаще наблюдается во второй и третьей декадах жизни. Патологический процесс может распространяться в поверхностные слои стромы, но степень изменений более легкая [2, 16].
Группа редко встречающихся стромальных дистрофий роговицы представлена пятью клиническими формами, наиболее детально изученными в генетическом аспекте. Все они, в сравнении с вышеописанной группой «передних» дистрофий роговицы, как правило сопровождаются существенным снижением зрения [8, 19].
Гранулярная стромальная дистрофия роговицы, манифестирующая в течение первой или второй декады жизни, представлена двумя клинико-генетическими вариантами, первый из которых обусловлен мутацией в гене TGFB1 на хромосоме 5q31 и имеет аутосомно-доминантный тип наследования, второй клинико-генетический вариант наследуется по аутосомно-рецессивному типу и связан с мутациями в гене CHST6, расположенном на хромосоме 16q22. Клиническим признаком гранулярной дистрофии роговицы служит наличие небольших отдельных серовато-белых гранул с четкими границами, располагающихся в строме изолированно друг от друга. Описанные патологические очаги представляют собой отложения гиалина. С течением времени гранул становится больше, сливаясь, очаги распространяются глубже в стромальные слои роговицы, захватывая зону зрачковой проекции, что приводит к выраженному снижению зрения, периферия роговицы при этом остается интактной. Рецидивирующие эрозии с болевым синдромом, свойственные заболеванию, возникают нечасто, однако могут иметь место до того, как зрение существенно снизится [1, 2, 19].
Генетически гетерогенной является решетчатая стромальная дистрофия роговицы, представленная тремя клинико-генетическими вариантами. Первый из них встречается наиболее часто, наследуется по аутосомно-доминантному типу, обусловлен мутациями в гене TGFB1, расположенном на хромосоме 5q31. Клинически данная форма характеризуется наличием тонких ветвящихся линий в передних или средних стромальных слоях, при этом изменения не затрагивают периферию роговицы. Второй клинико-генетический вариант связан с системным амилоидозом, имеет аутосомно-доминантный тип наследования, обусловлен мутациями в гене GSN, расположенном на хромосоме 9q34. Решетчатые линии, начинающиеся на периферии и продвигающиеся к центру, при данном заболевании толще, но их существенно меньше, чем при первом типе. Острота зрения, как правило, высокая. Третий тип решетчатой дистрофии характеризуется аутосомно-рецессивным типом наследования, связан с мутациями в гене M1S1 на хромосоме 1р32. Решетчатые линии в данном варианте более грубые и шероховатые, располагаются по всему диаметру роговицы. Все представленные клинико-генетические варианты манифестируют в детстве или молодом возрасте и могут сопровождаться рецидивирующими эрозиями с болевым синдромом, приводящими в дальнейшем к фиброзированию и грубому рубцеванию патологических очагов [2, 19].
Клиническим сочетанием гранулярной и решетчатой дистрофий является дистрофия Авеллино, обусловленная мутациями в гене TGFB1 на хромосоме 5q31 и наследуемая по аутосомно-доминантному типу. Биомикроскопически определяются гранулированные зернистые помутнения, располагающиеся в передних слоях стромы, напоминающие гранулярную дистрофию, в сочетании с тонкими линиями, характерными для решетчатой стромальной дистрофии роговицы. Как и при большинстве стромальных дистрофий, симптоматически отмечаются рецидивирующие эрозии с болевым синдромом и ощутимое снижение остроты зрения [11].
Крайне редким поражением, вызывающим засветы и снижение зрения, является пятнистая, или макулярная, дистрофия стромы роговицы. Заболевание наследуется по аутосомно-рецессивному типу наследования и обусловлено мутацией на хромосоме 16q22, на настоящий момент ген не идентифицирован. Для данной дистрофии свойственно наличие центрально расположенных бело-серых очагов, имеющих тенденцию к слиянию, но все же относительно изолированных друг от друга, с диффузным помутнением участков стромы между ними. Особенностью макулярной дистрофии является тот факт, что патологические очаги, расположенные наиболее центрально, являются поверхностными, периферические очаги, напротив, поражают строму роговицы на всю толщу [8, 21].
Заключительным вариантом стромальных дистрофий роговицы представлена кристаллическая дистрофия Шнайдера, обусловленная отложениями холестерина в роговице при гиперхолестеринемии и гиперглицеридемии. Описанная патология развивается в связи с мутациями в гене UBIAD1, расположенном на хромосоме 1р36.3, имеет аутосомно-доминантный тип наследования и чаще выявляется у лиц пожилого возраста, хотя манифестирует ранее. Клинически дистрофия Шнайдера характеризуется появлением облаковидных желтоватых кристаллических депозитов холестерина в центральной зоне роговицы, в периферической ее части имеется характерное выступающее липоидное кольцо [21].
В отличие от вышеизложенных стромальных дистрофий роговицы группа «задних», эндотелиальных, дистрофий наименее разнообразна и представлена тремя клиническими формами, имеющими сходную симптоматику и клинические проявления [3, 14].
Первой и самой распространенной патологией является эндотелиальная дистрофия роговицы Фукса, наследуемая по аутосомно-доминантному типу. Являясь генетически гетерогенной формой, дистрофия Фукса включает в себя 7 клинико-генетических вариантов, которые обусловлены мутациями в генах COL8A2, расположенных на хромосоме 1р34.3-р32.3, SLC4A11 — на хромосоме 20р13-р12, ZEB1 — на хромосоме 10р11.2 и AGBL1, расположенном на хромосоме 9q34.1. Для некоторых клинико-генетических вариантов к настоящему моменту определены только хромосомные локусы без идентификации задействованных генов. Дистрофия роговицы Фукса связана со снижением плотности и функциональной активности клеток заднего эпителия (эндотелия) роговицы. Заболевание манифестирует при декомпенсации клеток эндотелия, выполняющих ключевую роль по поддержанию постоянного уровня гидратации стромы роговицы. Клинически это проявляется отеком роговицы различной степени выраженности и возникновением симптомов раздражения интрастромальных нервных окончаний с развитием светобоязни, слезотечения, появлением ощущения инородного тела, блефароспазма. На поздних стадиях в результате выраженного нарушения тканевого метаболизма и гипоксии происходит прорастание сосудов в строму роговицы, замещение прозрачной стромы очагами фиброцеллюлярной ткани, что снижает остроту зрения вплоть до светоощущения [10, 12, 18, 25].
К крайне редкому варианту «задних» дистрофий можно отнести наследственную врожденную эндотелиальную дистрофию роговицы. Для этого заболевания характерно появление отека роговицы на первых месяцах жизни ребенка с последующим развитием патологического процесса, как при дистрофии роговицы Фукса. Глаукома возникает в подростковом возрасте как осложнение данного заболевания. При этом указанная патология представлена двумя клинико-генетическими формами. Первая из них является прогрессирующей, манифестирует в первые два года жизни ребенка и обусловлена мутациями в неидентифицированном гене, картированном в области хромосомы 20р11.2-q11.2, тип наследования — аутосомно-доминантный. Вторая клинико-генетическая форма наследуется по аутосомно-рецессивному типу, связана с мутациями в гене SLC4A11, расположенном на хромосоме 20р13-p12. Данная форма возникает сразу при рождении и в дальнейшем практически не прогрессирует [15, 22].
Самым редким вариантом эндотелиальных дистрофий роговицы является задняя полиморфная дистрофия. Данная патология, являясь аутосомно-доминантным заболеванием, связана с мутациями в генах VSX1, расположенном на хромосоме 20p11.2, COL82A — на хромосоме 1p34.3-p32.3, ZEB1 — на хромосоме 10p11.2. Особенностью задней полиморфной дистрофии роговицы является тот факт, что гистологически эндотелиальные клетки выглядят как эпителиальные, при этом у них имеются микроворсинки, которые в норме не наблюдают. Клиническая симптоматика сходна с другими вышеописанными патологиями из группы «задних» дистрофий роговицы. При этом первые симптомы могут возникнуть сразу после рождения, однако многие пациенты не отмечают жалоб в течение всей жизни [15].
Таким образом, изложенная выше характеристика наследственных дистрофий роговицы не оставляет сомнений в том, что дифференциальная диагностика представленной патологии, основанная исключительно на клинической картине заболевания и симптоматики конкретного пациента, является односторонней и крайне неполноценной. Разработка новых подходов, основанных на сочетанном изучении клинических признаков заболевания и их корреляции с результатами генетического анализа, представляет собой фундамент для комплексной патогенетически ориентированной диагностики наследственных дистрофий роговицы. Данный подход может стать основой для разработки перспективных методов профилактики и лечения целого ряда врожденных и генетически детерминированных заболеваний органа зрения.
Поступила 14.10.2015
Сведения об авторах:
Малюгин Борис Эдуардович, докт. мед. наук, профессор, зам. ген. директора по научной работе;
Антонова Ольга Павловна, аспирант
ФГАУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Фёдорова» Минздрава России, Москва
- З.С. Смирнова, Л.М. Борисова, М.П. Киселева и др. Противоопухолевая активность соединения ЛХС-1208 (N-гликозилированные производные индоло[2,3-а]карбазола) // Российский биотерапевтический журнал 2010. № 1. С. 80.
- А.В. Ланцова, Е.В. Санарова, Н.А. Оборотова и др. Разработка технологии получения инъекционной лекарственной формы на основе отечественной субстанции производной индолокарбазола ЛХС-1208 // Российский биотерапевтический журнал. 2014. Т. 13. № 3. С. 25-32.
- М.П. Киселева, З.С. Шпрах, Л.М. Борисова и др. Доклиническое изучение противоопухолевой активности производного N-гликозида индолокарбазола ЛХС-1208. Сообщение II // Российский биотерапевтический журнал. 2015. № 3. С. 41-47.
- https://ilive.com.ua/health/distrofiya-degeneraciya-rogovicy_108083i15936.html.
- https://eyepress.ru/article.aspx?19475.
- А.В. Ланцова, Е.В. Санарова, Н.А. Оборотова и др. Разработка технологии получения инъекционной лекарственной формы на основе отечественной субстанции производной индолокарбазола ЛХС-1208 // Российский биотерапевтический журнал. 2014. Т. 13. № 3. С. 25-32.